Es razonable esperar que el volumen de cualquier fase a temperatura constante sea expresable como una serie de potencias de la presión.
Como el volumen es una magnitud extensiva conviene referirlo a
una porción de materia. Podemos elegir el número de moléculas ![]() ,
como medida
de esa porción y entonces veremos que el término más significativo
de esa serie es idéntico, para todos los gases.
Definiendo el mol como cierta cantidad entera de moleculas
,
como medida
de esa porción y entonces veremos que el término más significativo
de esa serie es idéntico, para todos los gases.
Definiendo el mol como cierta cantidad entera de moleculas ![]() ,
tenemos que
,
tenemos que
![]() , donde
, donde ![]() es el número de Avogadro, una
cantidad arbitraria definida históricamente
para que en condiciones
normales un gas ocupe cierto volumen. Por ello diremos que
es el número de Avogadro, una
cantidad arbitraria definida históricamente
para que en condiciones
normales un gas ocupe cierto volumen. Por ello diremos que ![]() si
si ![]() es una magnitud extensiva. Entonces:
es una magnitud extensiva. Entonces:
| (1) |
Definimos
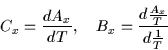 |
(2) |
quedando
| (3) |
Todos estos coefientes ![]() son
funciones solamente de la temperatura.
son
funciones solamente de la temperatura.
Utilizando
| (4) |
integramos
| (5) |
y obtenemos:
| (6) |